RENCANA PELAKSANAAN PEMBELAJARAN
IKATAN KIMIA
I. INFORMASI
UMUM
A. Identitas Modul
Nama : Yusea Gitaria, S.Si.
Instansi : SMA Negeri 14 Tangerang
Tahun Penyusunan : 2024
Jenjang Sekolah : SMA
Mata Pelajaran : Kimia
Fase/Kelas : F / XI
Materi : Ikatan Kimia
Alokasi waktu : 6
x 45 menit
Jumlah Pertemuan : 3
Pertemuan
Kata
Kunci : Kestabilan
Atom, Ikatan Ionik, Ikatan Kovalen
Jumlah
Murid : 35 siswa
Moda : Tatap muka
B. Kompetensi Awal
Peserta didik telah memiliki pengetahuan awal tentang:
·
Konfigurasi elektron
·
Elektron valensi
Murid
diberikan penugasan mengamati video pembelajaran tentang konfigurasi elektron
dan elektron valensi sebagai penguatan pemahaman
C. Profil Pelajar
Pancasila
Setelah menyelesaikan
pembelajaran ini, peserta didik diharapkan dapat mengembangkan diri sesuai
dengan profil pelajar pancasila, dimensi Beriman, bertakwa kepada Tuhan YME,
dan berakhlak mulia, Berkebinekaan Global, bergotong royong bernalar kritis,
serta Kreatif
Beriman, bertakwa kepada
Tuhan YME, dan berakhlak mulia :
Menghargai hubungan sesama
manusia dan semua ciptaan Tuhan termasuk mewujudkan akhlak yang mulia pada diri
masing-masing murid
Berkebinekaan Global :
Menumbuhkan rasa menghormati
terhadap keanekaragaman budaya, menghilangkan prasangka, hingga merefleksikan
diri terhadap nilai-nilai kebhinekaan.
Bergotong royong :
Memiliki kemampuan untuk
melakukan kolaborasi dengan sukarela agar kegiatan yang dikerjakan dapat
berjalan lancar dan mencapai tujuan untuk kebaikan bersama.
Bernalar Kritis :
Berpikir secara objektif,
sistematik dan saintifik dengan mempertimbangkan berbagai aspek berdasarkan
data dan fakta yang mendukung, sehingga dapat membuat keputusan yang tepat dan
berkontribusi memecahkan masalah dalam kehidupan, serta terbuka dengan penemuan
baru
Kreatif :
Mampu berkontribusi dalam
memberikan gagasan, menciptakan karya, serta mampu memecahkan masalah
D. Sarana dan
Prasarana
Sarana : Laptop
dan LCD
Prasarana : LKPD, alat tulis, pensil, jaringan internet, whiteboard,
spidol boardmarker, dan bahan tayang.
E. Target
Peserta didik
1. Peserta didik
reguler/tipikal.
2. Peserta didik dengan kesulitan belajar (hanya menonjol pada salah
satu gaya belajar saja).
3. Peserta didik dengan
pencapaian tinggi.
F. Model Pembelajaran
Pembelajaran dilakukan
secara luring/tatap muka dengan menerapkan model pembelajaran discovery
learning.
II. KOMPONEN INTI
A. Tujuan Pembelajaran
Dengan serangkaian kegiatan pembelajaran yang bervariatif diharapkan murid kelas XI B mampu mempresentasikan tentang kestabilan atom dengan baik.
B. Pemahaman Bermakna
Atom yang tidak
stabil memiliki kecenderungan untuk mencapai konfigurasi elektron stabil dengan
cara:
· Melepaskan
elektron : Menjadi ion positif (kation)
· Menerima elektron : Menjadi
ion negatif (anion)
· Berbagi elektron : Tidak
menjadi ion
C. Pertanyaan Pemantik
· Mengapa beberapa
atom mudah bereaksi dengan atom lain, sedangkan yang lain tidak?
· Bagaimana ikatan
kimia dapat menghasilkan senyawa dengan sifat yang berbeda dari atom
penyusunnya?
· Bagaimana
pemahaman tentang ikatan kimia dapat membantu kita memahami fenomena kimia
sehari-hari, seperti korosi dan pembakaran?
D. Kegiatan Pembelajaran
Kegiatan pembelajaran yang digunakan untuk mencapai tujuan pebelajaran yang telah ditetapkan, dilakukan sesuai dengan model pembelajaran discovery learning sebagai berikut..
B. BAHAN BACAAN
IKATAN KIMIA
Perhatikan dua contoh senyawa berikut. “ C18H24O6 dan C19H28O6 “ “Apa yang membedakan kedua senyawa itu?” Tentunya Jumlah atom C dan atom H. Kedua senyawa tersebut adalah dua senyawa yang berbeda.
 |
| Gambar 1. Struktur hormon estrogen pada wanita (Sumber: belajaraktif.com) |
Yang pertama adalah estrogen yaitu hormon yang bertanggung jawab atas sifat kewanitaan. Sedangkan yang kedua adalah testosteron yaitu hormon yang bertanggung jawab atas sifat kelaki-lakian. Hal yang menarik di sini adalah adanya interaksi antara C, H, O yang sedikit beda jumlah atom bisa menyebabkan perbedaan jenis kelamin. Mirip, tapi sama sekali berbeda, bukan? Bayangkan! ikatan kimia antar 118 atom unsur dalam SPU bisa menghasilkan berapa milyar senyawa yang berbeda? Mengapa mereka saling berinteraksi? Bagaimana mereka saling berinteraksi? Yuk ikutin pembahasan ikatan kimia pada modul ini, semangat …!
1. Kestabilan unsur-unsur
Unsur-unsur dialam umumnya tidak stabil sehingga ditemukan dalam bentuk senyawanya. Atom-atom unsur tersebut saling berikatan membentuk molekul unsur atau molekul senyawa, untuk mencapai keadaan yang lebih stabil. Gas mulia merupakan unsur golongan VIII A dan bersifat inert. Hal ini karena gas mulia sulit bereaksi dengan atom unsur lainnya. Di alam, gas mulia berada sebagai atom tunggal. Atom-atom gas mulia bersifat stabil karena kulit terluarnya terisi penuh oleh elektron. Perhatikan Tabel 1 konfigurasi elektron gas mulia.
 |
| Tabel 1. Konfigurasi elektron beberapa unsur gas mulia |
G.N. Lewis (Amerika) dan W. Kossel (Jerman)
menjelaskan bahwa kestabilan suatu atom unsur dalam ikatan kimianya, terkait
dengan upaya atom unsur tersebut untuk memiliki konfigurasi elektron seperti
gas mulia terdekat.
- Dikemukakan bahwa jumlah elektron pada kulit
terluar dari dua atom yang berikatan akan berubah sedemikian rupa sehingga
konfigurasi elektron kedua atom tadi sama dengan konfigurasi elektron gas mulia
yaitu mempunyai 8 elektron pada kulit terluarnya. Pernyataan ini disebut aturan
oktet
- Unsur-unsur dengan nomor atom kecil seperti
H dan Li, stabil dengan 2 elektron valensi seperti He, disebut aturan duplet
Aturan duplet : konfigurasi elektron stabil
dengan 2 elektron pada kulit terluar.
Aturan oktet : konfigurasi elektron stabil
dengan 8 elektron pada kulit terluar
Suatu atom dapat mencapai kestabilan
konfigurasi elektron gas mulia dengan cara melepaskan elektron, menangkap
elektron, atau berbagi elektron.
Contoh:
-
Unsur natrium, 11Na
: 1s2 2s2 2p6 3s1 , mempunyai
elektron valensi satu, sesuai kaidah oktet unsur ini akan stabil dengan cara
melepaskan 1e tersebut membentuk ion Na+
Na → Na+ + e
1s2 2s2 2p6 (
sama dengan konfigurasi elektron 10Ne )
-
Unsur 13Al
: 1s2 2s2 2p6 3s2 3p1 ,
mempunyai elektron valensi tiga, sesuai kaidah oktet unsur ini akan stabil
dengan cara melepaskan 3e tersebut membentuk ion Al3+ .
Al → Al3+ + 3e
1s2 2s2 2p6 (
sama dengan konfigurasi elektron 10Ne )
-
Unsur 8O
: 1s2 2s2 2p4 , mempunyai elektron valensi 6,
sesuai kaidah oktet unsur ini akan stabil dengan cara menyerap 2e membentuk ion
O2-
O + 2e → O2–
1s2 2s2 2p6 (
sama dengan konfigurasi elektron 10Ne )
-
Unsur 17Cl
: 1s2 2s2 2p6 3s2 3p5 ,
mempunyai elektron valensi 7, sesuai kaidah oktet unsur ini akan stabil dengan
cara menyerap 1 elektron membentuk ion Cl–
Cl + e → Cl–
1s2 2s2 2p6
3s2 3p6 ( sama dengan konfigurasi elektron 18Ar
)
Jadi unsur logam akan melepaskan elektron
valensinya membentuk ion positif (+), sedangkan unsur nonlogam akan menangkap elektron
membentuk ion negatif (-)
Pada saat atom-atom membentuk ikatan, hanya elektron-elektron pada kulit terluar yang berperan yaitu elektron valensi. Elektron valensi dapat digambarkan dengan struktur Lewis yaitu lambang kimia suatu atom atau ion yang dikelilingi oleh titik-titik elektron valensi. Coba cermati tabel berikut :
Tabel 2. Struktur Lewis unsur-unsur golongan
utama (Sumber : Setiyana, 2015)
Contoh soal
Gambarkan simbol Lewis untuk atom 17Cl,
8O dan 11Na !
Jawab
|
Unsur |
Konfigurasi
elektron |
Elektron
valensi |
Rumus lewis |
|
17Cl |
1s2
2s2 2p6 3s2 3p5 |
7 |
|
|
8O |
1s2
2s2 2p4 |
6 |
|
|
11Na |
1s2
2s2 2p6 3s1 |
1 |
Na . |
2. Pembentukan ikatan ion
Ikatan ion atau elektrovalen umumnya terbentuk antara atom logam dan non logam. Hal ini terjadi karena atom unsur logam cenderung melepas elektron membentuk ion positif (+) dan atom unsur non logam cenderung menangkap elektron sehingga membentuk ion negatif (-). Ikatan antara ion positif dengan ion negatif melalui gaya elektrostatis disebut ikatan ion. Perhatikan gambar berikut:
 |
| Gambar 2 Unsur-unsur pembentuk anion dan kation (Sumber : Masterton, Hurley, 2010) |
Contohnya
a. Senyawa garam dapur, NaCl , terbentuk dari ikatan ion antara atom Na dengan atom Cl.
- 11Na : 1s2
2s2 2p6 3s1
Na → Na+ + e
- 17Cl : 1s2
2s2 2p6 3s2 3p5
Cl +
e → Cl-
- Ikatan ion
Na+ + Cl- → NaCl
Ilustrasi
pembentukan ikatan ion
b. Senyawa garam
dapur, NaCl , terbentuk dari ikatan ion antara
atom Na dengan atom Cl.
- 20Ca : 1s2
2s2 2p6 3s2 3p6 4s2
Ca → Ca2+ + 2e
- 17Cl : 1s2
2s2 2p6 3s2 3p5
Cl +
e → Cl-
- Ikatan ion
Ca2+ + 2Cl- → CaCl2
Ilustrasi pembentukan ikatan ion
3. Sifat fisis senyawa ion
Sifat fisis senyawa ion ditentukan oleh gaya elektrostatis yang kuat antara ion positif dan negatif senyawa tersebut. Dalam fase padat, membentuk struktur kristal. Contoh Susunan ion-ion Na+ dan Cl- yang membentuk struktur kristal NaCl.
Setiap ion Na+ dikelilingi oleh 6 ion Cl- dan setiap
ion Cl- dikelilingi oleh 6 ion Na+.
 |
| Gambar 3. Ilustrasi struktur kristal NaCl (Sumber : Setiyana, 2015) |
Beberapa sifat fisis senyawa ion lainnya adalah :
a. Bersifat keras tetapi rapuh
Jika senyawa ion dikenakan suatu
energi, misalnya dipukul menggunakan palu, lapisan yang terkena pukulan akan
bergeser. Ion-ion yang muatannya sama akan saling menolak. Tolak-menolak antar
ion inilah yang menyebabkan kekuatan ikatan ion akan berkurang sehingga senyawa
ion bersifat mudah rapuh. Perhatikan ilustrasi berikut:
 |
| Gambar 2. Ilustrasi sifat rapuh senyawa ion (Sumber : Setiyana, 2015) |
b. Mempunyai titik leleh dan titik didih yang tinggi.
Ikatan ion antara kation dan anion
sangat kuat. Untuk memutuskan ikatan ion diperlukan energi yang cukup besar.
inilah penyebab senyawa ion mempunyai titik didih dan titik leleh yang cukup
tinggi. Contohnya : NaCl mempunyai titik leleh 801 oC dan titik didih 1.465 oC.
c. Larut dalam pelarut air, tetapi umumnya tidak larut dalam pelarut organik.
d. Bersifat konduktor listrik
Tidak menghantarkan listrik pada fase padat, tetapi menghantarkan listrik
dalam fase cair (lelehannya) atau jika larut dalam air.
1. Pembentukan
ikatan kovalen
Ikatan kovalen
terbentuk akibat kecenderungan atom-atom untuk menggunakan elektron bersama (share
elektron) agar memiliki konfigurasi elektron seperti gas mulia
terdekat. Atom-atom yang berikatan
kovalen umumnya adalah antara atom-atom non logam.
Penggunaan
pasangan elektron dalam ikatan kovalen dapat digambarkan dengan struktur Lewis.
Struktur Lewis menggambarkan jenis atom-atom dalam molekul dan bagaimana
atom-atom tersebut terikat satu sama lain.
a. Ikatan kovalen tunggal
Ikatan kovalen
tunggal adalah ikatan kovalen yang melibatkan penggunaan 1 pasangan elektron (2
elektron) oleh dua atom yang saling berikatan. Contohnya pembentukan senyawa
HCl dan CH4
-
Pembentukan HCl Konfigurasi elektron 1H : 1s1 sehingga elektron valensinya = 1. Untuk
mencapai konfigurasi elektron yang stabil (sesuai kaidah duplet) diperlukan 1
elektron . Konfiguarsi elektron 17Cl : 1s2
2s2 2p6 3s2 3p5 sehingga CI
mempunyai elektron valensi = 7. Untuk mencapai konfigurasi elektron yang stabil
(sesuai kaidah oktet) diperlukan 1 elektron, maka struktur Lewis pembentukan
HCl
- Pembentukan CH4
Konfigurasi elektron 1H : 1s1 sehingga elektron valensinya = 1. Untuk
mencapai konfigurasi elektron yang stabil (sesuai kaidah duplet) diperlukan 1
elektron. 6C : 1s2
2s2 2p2 sehingga
elektron valensinya = 4. Untuk mencapai konfigurasi elektron yang stabil
(sesuai kaidah oktet) diperlukan 4 elektron, maka struktur Lewis pembentukan CH4
b. Ikatan kovalen rangkap dua dan rangkap tiga
Ikatan kovalen
rangkap dua adalah ikatan kovalen yang melibatkan penggunaan bersama 2 pasangan elektron (4 elektron) oleh dua atom
yang saling berikatan, jika pasangan elektron yang digunakan bersama sebanyak 3
pasang disebut ikatan kovalen rangkap tiga. Contoh:
- Pembentukan O2
Konfigurasi
elektron 16O : 1s2 2s2 2p6
3s2 3p4 sehingga
elektron valensinya = 6, untuk mencapai
konfigurasi elektron yang stabil (sesuai kaidah oktet) diperlukan 2 elektron,
maka struktur Lewis pembentukan O2
- Pembentukan N2
Konfigurasi
elektron 7N : 1s2 2s2 2p3 sehingga elektron valensinya = 5, untuk
mencapai konfigurasi elektron yang stabil (sesuai kaidah oktet) diperlukan 3
elektron ., maka struktur Lewis pembentukan N2
Contoh soal
Jelaskan
pembentukan senyawa Cl2 dan CO2 menggunakan struktur lewis!
Jawab
1)
Pembentukan senyawa Cl2
Konfigurasi
elektron 17Cl : 1s2 2s2 2p6
3s2 3p5 sehingga
elektron valensinya = 7, untuk mencapai
konfigurasi elektron yang stabil (sesuai kaidah oktet) diperlukan 1 elektron,
maka struktur Lewis pembentukan Cl2
2) Pembentukan CO2
Konfigurasi
elektron 16O : 1s2 2s2 2p6
3s2 3p4 sehingga
elektron valensi-nya = 6, untuk mencapai
konfigurasi elektron yang stabil (sesuai kaidah oktet) diperlukan 2 elektron.
Konfigurasi elektron 6C : 1s2
2s2 2p2 sehingga
elektron valensinya = 4. Untuk mencapai konfigurasi elektron yang stabil
(sesuai kaidah oktet) diperlukan 4 elektron, maka struktur Lewis pembentukan CO2
2. Ikatan kovalen koordinasi
Ikatan kovalen
koordinasi adalah Ikatan kovalen yang pasangan elektron yang digunakan untuk
berikatan hanya berasal dari salah satu
atom. Coba perhatikan contoh pembentukan ikatan kovalen koordinasi pada ion H3O+ berikut :
- Reaksi : H2O
+ H+ → H3O+
- Struktur
Lewis :

(Tanda panah,
→ , menunjukkan pasangan elektron ikatan
kovalen koordinat berasal dari atom oksigen) - Keterangan: Ion hidronium, H3O+
dibentuk dari molekul H2O yang mengikat ion H+ . Pada
molekul H2O, atom oksigen mempunyai dua pasang elektron bebas sedangkan ion H+ tidak mempunyai elektron. Ikatan kovalen koordinasi terbentuk oleh
salah satu pasangan elektron bebas dari oksigen dengan ion H+.
Ikatan kovalen
koordinat terbentuk jika pasangan elektron yang digunakan bersama berasal dari
salah satu atom
Contoh soal:
Jelaskan bagaimana pembentukan ikatan kovalen koordinasi pada ion NH4+.
Jawab
Reaksi : NH3 + H+
→ NH4+
Ion NH4+
dibentuk dari molekul NH3 yang mengikat ion H+. Pada molekul NH3 atom
nitrogen mempunyai sepasang elektron bebas yang digunakan untuk mengikat ion
H+ sehingga terbentuk ikatan kovalen
koordinasi.
Struktur Lewis :
(Tanda panah, → , menunjukkan pasangan elektron ikatan kovalen koordinat berasal dari atom nitrogen)
3. Sifat-sifat
fisis ikatan kovalen
a.
Senyawa kovalen ada yang membentuk struktur molekul sederhana
misalnya CH4 dan H2O, ada juga yang membentuk struktur
molekul raksasa seperti SiO2.
Selain itu ada atom-atom yang
membentuk struktur kovalen raksasa contohnya karbon dalam intan.
b.
Titik didih senyawa kovalen bervariasi, ada yang rendah dan
sangat tinggi.
 |
Tabel 3. Titik didih beberapa senyawa kovalen (Sumber : Visual encyclopedia) |
c. Metana memiliki fase gas, pada setiap molekulnya terdapat
ikatan kovalen yang relatif kuat. Di antara molekul-molekul CH4 terdapat gaya
antarmolekul yang lemah. Pada saat dipanaskan, masing-masing molekul CH4 mudah
berpisah, sehingga titik didih metana rendah. d. Pada intan, atom C dengan C
lainnya berikatan kovalen sangat kuat, membentuk struktur raksasa sehingga
titik didihnya tinggi. Senyawa dengan
struktur molekul raksasa tidak larut dalam air dan tidak menghantarkan listrik
kecuali grafit yaitu karbon pada batu baterai dan isi pensil
4. Ikatan logam
Pernahkan kalian
bertanya mengapa kawat tembaga dapat digunakan sebagai penghantar listrik dalam
kabel? Atau emas, perak dapat digunakan untuk perhiasan dalam bentuk yang indah?
Benarkah semua itu berkaitan dengan sifat ikatan logam? Yuk simak penjelasan
berikut:
Atom logam
mempunyai keelektronegatifan rendah, artinya mereka cenderung mudah melepaskan
elektron terluarnya. Jika atom logam melepaskan elektron maka terbentuk kation
atau ion positif. Elektron-elektron dari atom logam ditemukan di dalam
kisi-kisi logam dan bebas bergerak diantara semua kation, membentuk lautan
elektron. Gaya elektrostatik antar muatan (+) logam dan muatan (–) dari
elektron akan menggabungkan kisi-kisi logam tersebut.
Tarik-menarik dari
kation di dalam lautan elektron yang bertindak sebagai perekat dan
menggabungkan kation-kation disebut ikatan logam.
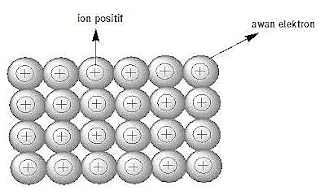 |
| Gambar 4. Ilustrasi ikatan logam |
Beberapa sifat fisis logam antara lain:
- Penghantar listrik dan panas yang baik
Elektron yang bebas bergerak pada lautan elektron menyebabkan logam dapat
menghantarkan listrik, sehingga logam banyak digunakan sebagai penghantar
listrik dalam kabel.
- Mempunyai titik leleh dan titik didih
yang tinggi Atom logam dengan atom logam tersusun rapat membentuk struktur
raksasa sehingga logam mempunyai titik leleh dan kekerasan yang tinggi. Dengan
demikian logam banyak digunakan sebagai penghantar panas.
- Bersifat keras namun tidak mudah patah
Hal ini menyebabkan logam mudah dibentuk dengan ditempa dan digunakan untuk
perhiasan atau pajangan dengan bentuk yang indah
C. GLOSARIUM
Aturan oktet : Kecenderungan unsur-unsur untuk memiliki
konfigurasi elektron pada kulit terluarsebanyak 8 elektron seperti gas mulia
Ne, Ar, Kr, Xe, Rn.
Aturan Duplet : Kecenderungan unsur-unsur untuk memiliki
konfigurasi elektron pada kulit terluarsebanyak 2 elektron seperti gas mulia
He
Struktur Lewis : Suatu cara yang diusulkan G.N. Lewis untuk
menggambarkan elektron valensi dari atom-atom dengan titik-titik. Simbol Lewis
adalah suatu atom atau ion terdiri dari lambang kimia yang dikelilingi oleh
titik elektron.
Ikatan ion : Disebut juga ikatan elektrovalen, adalahikatan
yang terjadi antara umumnya ion positif (+) atom unsur logam dan ion negatif
(-) atom unsur non logam melalui gaya elektrostatik .
Ikatan kovalen : Disebut juga ikatan homovalen, terbentuk akibat
kecenderungan atom-atom untuk menggunakan elektron bersama (share elektron)
agar memiliki konfigurasi elektron seperti gas mulia terdekat. Atom-atom yang
berikatan kovalen umumnya adalah antara atom-atom non logam.
Ikatan kovalen tunggal : Ikatan kovalen yang
melibatkan penggunaan 1 pasangan elektron (2 elektron) oleh dua atom yang
saling berikatan.
Ikatan kovalen rangkap : Ikatan kovalen yang
melibatkan penggunaan bersama 2 pasangan elektron (4 elektron) oleh dua atom
yang saling berikatan.
Ikatan kovalen rangkap tiga : Ikatan yang terbentuk jika terjadi penggunaan bersama 3 pasangan
elektron (6 elektron) oleh dua atom yang berikatan.
Ikatan kovalen koordinasi : Ikatan kovalen
yang pasangan elektron yang digunakan untuk berikatannya hanya berasal dari
salah satu atom
Ikatan logam : Tarik-menarik dari kation di dalam lautan elektron yang bertindak
sebagai perekat dan menggabungkan kation-kation
D. DAFTAR PUSTAKA
https://sumberbelajar.belajar.kemdikbud.go.id/sumberbelajar/tampil/Sel-Elektrokimia2015/konten1.html.
Diakses 9 September 2020
Mcmurry
, John e & Fay , Robert c & Fantini , Jordan. 2012. Chemistry. London:
Prentice Hall.
Masterton
, William L., Hurley , Cecile N., Neth ,Edward. 2011. Chemistry: Principles and
Reactions. Cengage Learning Published
Setiyana.
2015. My Dream In Chemistry, Kelas XII MIPA semester 1. Bandung : Tinta Emas
Publishin






.jpeg)

.jpeg)
.jpeg)

.jpeg)

.jpeg)
.jpeg)

.jpeg)

.jpeg)







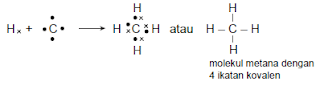








Tidak ada komentar:
Posting Komentar