TERMOKIMIA
ENTALPI
A. Perubahan Energi dalam Reaksi
Dalam
termokimia ada dua hal yang harus diperhatikan berkaitan dengan perpindahan
energi, yaitu sistem dan lingkungan. Segala sesuatu yang
menjadi pusat perhatian disebut sistem, sedangkan hal-hal yang
berada di luar sistem disebut lingkungan.
Contoh :
Pada reaksi
antara NaOH dan HCl dalam suatu tabung reaksi, terjadi kenaikan suhu, sehingga
suhu pada tabung reaksi naik.
Pada contoh
tersebut yang menjadi pusat perhatian adalah reaksi antara NaOH dan HCl yang
disebut sistem, sedangkan tabung reaksi, suhu udara, tekanan udara adalah
lingkungan karena merupakan hal-hal yang berada di luar sistem.
Berdasarkan
interaksinya dengan lingkungan sistem dibedakan menjadi tiga bagian, yaitu sistem
terbuka, sistem tertutup dan sistem terisolasi.
1.
Sistem terbuka
Sistem terbuka adalah suatu sistem yang memungkinkan
perpindahan panas antara lingkungan dengan sistem
Contoh :
Pada reaksi antara logam magnesium dengan
HCl encer dalam suatu tabung reaksi terbuka, dengan reaksi berikut :
Mg(s)
+ 2HCl(aq) → MgCl2(aq) + H2(g)
Pada reaksi tersebut menghasilkan gas hidrogen yang keluar dari sistem merambat
ke lingkungan pada udara terbuka dan panas yang dihasilkanpun akan merambat keluar
dari sistem ke lingkungan, karena tabung
reaksi yang digunakan dalam kondisi terbuka.
2. Sistem tertutup
Sistem tertutup adalah suatu sistem yang memungkinkan terjadinya
perpindahan panas antara sistem dan lingkungan, tetapi tidak terjadi pertukaran
materi.
Contoh :
Jika reaksi
antara logam magnesium dengan HCl encer dilakukan dalam suatu tabung reaksi
yang tertutup, maka gas hidrogen (materi) yang dihasilkan tidak akan keluar atau
meninggalkan sistem. Panas yang dihasilkan akan keluar dari sistem dengan cara merambat
ke tabung reaksi, sehingga tabung reaksi akan mengalami peningkatan suhu.
3. Sistem terisolasi
Sistem terisolasi merupakan suatu sistem yang tidak memungkinkan terjadinya perpindahan materi dan panas antara sistem dan lingkungan.
Contoh :
Jika reaksi
antara logam magnesium dengan HCl encer dilakukan dalam suatu tempat reaksi
yang tertutup sangat rapat (teisolasi), seperti pada tempat penyimpanan air
panas (termos)
B. Entalpi dan Perubahan Entalpi
1.
Entalpi dan Perubahan Entalpi
Dalam termodinamika dikenal dengan Entalpi
(H) yang didefinisikan
sebagai berikut:
H = E
+ P V
Dengan H
adalah energi dalam sistem, P adalah
tekanan sistem dan V adalah Volume
sistem. Nilai E + P.V tergantung dari kondisi awal dan kondisi akhir. Dengan
demikian terjadilah perubahan entalpi (∆H) yang hanya tergantung pada
keadaan awal dan keadaan akhir.
Oleh sebab itu nilai perubahan entalpi (∆H) sustu
sistem dinyatakan sebagai selisih besar entalpi sistem setelah mengalami
perubahan dengan besar entalpi sistem sebelum perubahan, pada tekanan tetap.
∆H = Hakhir - Hawal
2.
Reaksi Endoterm dan reaksi eksoterm
Reaksi endoterm adalah reaksi yang disertai perpindahan kalor dari lingkungan ke dalam sistem, atau dapat dikatakan bahwa reaksi endoterm adalah reaksi yang sistemnya menyerap kalor. Sedangkan reaksi eksoterm adalah reaksi yang disertai perpindahan kalor dari sistem ke lingkungan, atau dapat dikatakan bahwa reaksi endoterm adalah reaksi yang sistemnya melepas kalor.
Pada reaksi endoterm nilai ∆H > 0 dan bernilai positif,
karena sistem menyerap kalor maka panas pada sistem menjadi bertambah sehingga
perubahan entalpinya positif.
Hawal < Hakhir
∆H = +
Sedangkan pada reaksi eksoterm nilai ∆H < 0 dan bernilai negatif, karena sistem melepaskan kalor maka panas pada
sistem menjadi berkurang sehingga perubahan entalpinya negatif.
Hawal > Hakhir
∆H = -
3. Persamaan Termokimia dan Diagram Energi
Persamaan termokimia adalah persamaan reaksi yang disertai informasi tentang jumlah mol zat pereaksi dan hasil reaksi (yang ditunjukkan oleh koefisien reaksi) dan perubahan entalpi reaksi (∆Ho) yang menyertai reaksi tersebut.
Contoh:
a.
H2(g)
+ ½ O2(g)
→
H2O(l) ∆H
= - 125 kJ
Persamaan reaksi ini menyatakan bahwa reaksi
pembentukan 1 mol H2O disertai dengan melepaskan kalor sebesar 125
kJ.
Catatan:
·
Reaksi pembentukan adalah jenis reaksinya membentuk H2O
·
1 mol H2O karena koefisien reaksi H2O
adalah 1
·
Melepaskan kalor karena ∆Hreaksi =
negatif (Reaksi Eksoterm)
b.
2H2O(l)
→ 2H2(g) + O2(g) ∆H = + 250
kJ
Persamaan reaksi ini menyatakan bahwa reaksi
penguraian 2 mol H2O disertai dengan menyerap kalor sebesar 250 kJ.
Catatan:
·
Reaksi penguraian adalah jenis reaksinya menguraikan H2O
·
2 mol H2O karena koefisien reaksi H2O
adalah 2
·
Menyerap kalor karena ∆Hreaksi = positif
(Reaksi Endoterm)
Diagram energinya
4.
Perubahan Entalpi Standar (∆Ho)
Perubahan entalpi standar dibedakan berdasar jenis
reaksi atau prosesnya, terbagi menjadi 3 bagian :
a.
Perubahan entalpi Pembentukan standar (∆Hf
o)
Perubahan entalpi pembentukan standar (Standart Entalpy of Formation) merupakan perubahan entalpi yang terjadi pada pembentukan 1 mol suatu senyawa dari unsur-unsurnya yang paling stabil pada keadaan standar.
Contoh :
Perubahan entalpi standar pembentukan amonium klorida
pada persamaan termokimia berikut
½N2(g)
+ 2H2(g)
+ ½Cl2 → NH4Cl(s) ∆Hf o = - 215 kJ/mol
Catatan : Pembentukan 1
mol NH4Cl melepas panas sebesar 215 kJ
b.
Perubahan entalpi Penguraian standar (∆Hd
o)
Perubahan entalpi penguraian standar (Standart Entalpy of Decomposition) merupakan perubahan entalpi yang terjadi pada peruraian 1 mol suatu senyawa menjadi unsur-unsurnya yang paling stabil pada keadaan standar.
Contoh :
Perubahan entalpi standar penguraian amonium klorida
pada persamaan termokimia berikut
NH4Cl(s) → ½N2(g) + 2H2(g) + ½Cl2 ∆Hf o = + 215 kJ/mol
Catatan : Penguraian 1
mol NH4Cl menyerap panas sebesar 215 kJ
c.
Perubahan entalpi Pembakaran standar (∆Hc
o)
Perubahan entalpi pembakaran standar (Standart Entalpy of Combustion) merupakan perubahan entalpi yang terjadi pada pembakaran 1 mol suatu zat sempurna dengan menambahkan oksigen.
Contoh :
Perubahan entalpi standar pembakaran metanol pada
persamaan termokimia berikut
CH3OH(l) + 3/2 O2(g) → CO2(g) + 2H2O(g) ∆Hc o = - 357 kJ/mol
Catatan : Pembakaran 1 mol CH3OH melepaskan panas sebesar 357 kJ
C. Penentuan Perubahan Entalpi
1. Kalorimeter
Rumus qkalorimeter = Cp . ∆T
qsistem = m . c . ∆T
Cp : kapasitas jenis kalorimeter
q : perubahan kalor (Joule)
m : massa zat (gram)
c : kalor jenis zat (J/gram oK)
∆T : perubahan suhu (oK)
Contoh soal
:
Dalam suatu kalorimeter born direaksikan 0,16 gram gas
metana (CH4) dengan oksigen berlebih, sehingga terjadi reaksi :
CH4(g)
+ 2O2(g) → CO2(g)
+ 2H2O(g)
terjadi kenaikan suhu sebesar 1,56oC.
Diketahui kapastas kalor kalorimeter adalah 958 J/oC, massa air di dalam
kalorimeter 1000 gram dan kalor jenis air 4,18 J/gr oC. Tentukan
kalor pembakaran gas metana dalam kJ/mol. (Ar C = 12; Ar H = 1; Ar O = 16)
Pembahasannya:
Kalor yang dilepas selama reaksi sama dengan kalor
yang diserap oleh air dalam kalorimeter dan oleh kalorimeter, maka :
qtotal = qsistem + qkalorimeter
qsistem = mair . cair . ∆T
= 1.000 gram x
4,18 J/gr oC x 1,56oC
= 6.520 J
qkalorimeter = Cp . ∆T
= 958 J/oC x 1,56oC
= 1.494 J
maka,
qtotal = 6.520
J +
1.494 J
= 8.014 J
= 8,014 kJ
Jumlah metana yang dibakar adalah 0,16
gram sehingga jumlah molnya adalah :
maka kalor yang dilepas untuk setiap reaksi pembakaran
1 mol CH4 adalah
Sehingga persamaan reaksi termokimianya:
CH4(g) + 2O2(g) → CO2(g)
+ 2H2O(g) ∆H = - 801,4 kJ/mol
Catatan : Pembakaran 1 mol CH4
melepaskan panas sebesar 801,4 kJ
2.
Hukum Hess
Pembahasannya dapat disimak pada website : Penjelasan Hukum Hess



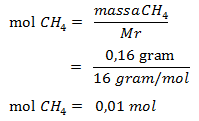





Tidak ada komentar:
Posting Komentar