 |
| Gambar 1. Peta Konsep Larutan Asam-Basa |
A.
SIFAT
ASAM – BASA
Asam dan Basa merupakan senyawa
kimia yang sangat penting dalam kehidupan sehari-hari. Asam dan Basa dapat
dibedakan dengan meggunakan zat tertentu yang disebut indikator atau dengan menggunakan
alat khusus.
Larutan asam dan basa dapat
diperoleh dengan melarutkan asam atau basa ke dalam air. Larutan ini juga
diperoleh melalui reaksi antara senyawa oksida dengan air. Reaksi antara oksida
asam dengan air akan menghasilkan larutan asam, sedangkan reaksi antara oksida
basa dengan air akan menghasilkan larutan basa.
Oksida adalah
senyawa yang terdiri dari unsur tertentu dengan oksigen. Oksida asam adalah
senyawa oksida yang berasal dari unsur non logam dengan oksigen, misalnya CO2,
SO2, P2O5, Cl2O7 dan
lain sebagainya.Oksida asam apabila direaksikan dengan air maka membentuk larutan
asam.
Contoh
:
CO2(g) + H2O(l) → H2CO3(aq)
SO2(g) + H2O(l) → H2SO4(aq)
P2O5(s)
+ H2O(l)
→ 2H3PO4(aq)
Cl2O7(s)
+ H2O(l)
→ 2HClO4(aq)
Oksida basa adalah senyawa oksida yang
berasal dari non logam dengan oksigen, misalnya Na2O, CaO, Fe2O3
dan lain sebagainya. Oksida basa bila dilarutkan ke dalam air akan membentuk
larutan basa.
Contoh
:
Na2O(s) + H2O(l) → 2NaOH(aq)
CaO(s) + H2O(l)
→ Ca(OH)2(aq)
Fe2O3(s) + H2O(l) → 2Fe(OH)3(aq)
Selain itu ada juga yang disebut
oksida amfoter, oksida yang dapat membentuk larutan asam ataupun larutan
basa tergantung lingkungannya. Pada saat lingkungan asam akan menjadi basa dan
pada saaat lingkungan basa akan menjadi asam, misalnya Al2O3
dan ZnO.
B.
TEORI
ASAM – BASA
Sifat asam dan basa dapat
dijelaskan berdasarkan teori asam basa Arrhenius. teori asam basa Bronsted-Lowry
dan teori asam basa G.N. Lewis. Ketiga teori ini saling melengkapi.
1.
Teori
Asam Basa Arrhenius
Svante Arrhenius (1887)
mengemukakan bahwa asam adalah suatu zat
yang apabila dilarutkan ke dalam air akan menghasilkan ion Hidrogen (H+).
Asam umumnya adalah senyawa kovalen yang akan bersifat asam apabila dilarutkan
ke dalam air.
Contoh:
HCl(aq) → H+(aq)
+ C l ̶ (aq)
Pada tabel 1 menunjukkan bahwa satu
senyawa asam bisa menghasilkan beberapa ion hidrogen (H+), satu ion,
dua ion dan ada yang tiga ion. Asam yang hanya menghasilkan satu ion hidrogen (H+)
disebut asam monoprotik dan asam yang menghasilkan dua ion hidrogen (H+)
disebut asam diprotik.
Menurut Arrhenius asam kuat adalah asam yang derajat
ionisasinya besar atau mudah terurai dan banyak menghasilkan ion H+.
Contoh asam kuat HF, HBr, HCl, HI, H2SO4, HNO3
dan HClO4.
Menurut Arrhenius basa
adalah adalah suatu zat yang apabila
dilarutkan ke dalam air akan menghasilkan ion hidroksida (OH ̶). Senyawa amonia (HN3)
adalah senyawa kovalen yang apabila dilarutkan ke dalam air akan bersifat basa,
karena setelah dilarutkan ke dalam air dapat menghasilkan ion OH ̶.
Beberapa contoh basa ditunjukkan pada tabel berikut:
Tidak semua senyawa yang mengandung
gugus –OH merupakan suatu basa. Contoh CH3COOH dan C6H5OH
justru merupakan asam.
Menurut Arrhenius basa kuat adalah basa
yang mudah terionisasi dalam larutannya dan banyak menghasilkan ion OH ̶ . Contoh KOH, NaOH, Ba(OH)2 dan Ca(OH)2.
2.
Teori
Asam Basa Bronsted-Lowry
Teori yang dikemukakan oleh Arrhenius
tidak dapat menjelaskan tentang sifat asam dan basa pada larutan yang bebas
air, atau pelarutnya bukan air. Misalnya asam asetat bila dilarutkan ke dalam
air akan bersifat asam, akan tetapi sifat asamnya tidak nampak bila dilarutkan
ke dalam benzena. Demikian juga dengan amonia (NH3) dalam
larutan natrium amida (NaNH2)
yang menunjukkan sifat basa walau tidak mengandung ion OH ̶ . Berdasarkan
kenyataan tersebut Johannes Bronsted dan Thomas Lowry secara terpisah
mengusulkan bahwa yang berperan dalam memberikan sifat asam dan basa suatu
larutan adalah ion H+ atau proton.
Menurut teori Bronsted-Lowry, asam adalah
spesi yang berperan sebagai proton donor (pemberi proton atau H+)
kepada suatu spesi yang lain. Sedangkan basa adalah spesi yang berperan sebagai proton akseptor (penerima proton atau H+).
Contoh 1:
Reaksi ke kanan
Molekul H2O
merupakan asam karena mendonorkan
ion H+ (proton donor) kepada
molekul H2O
untuk membentuk molekul H3O+ (jumlah atom H
bertambah) dan molekul H2O adalah basa karena menerima ion H+ (proton akseptor) dari
molekul H2O.
Reaksi ke kiri
Molekul H3O+ merupakan asam karena mendonorkan ion H+ (proton donor) kepada
molekul ion OH ̶ untuk
membentuk molekul
H2O (jumlah atom H bertambah) dan molekul OH ̶ adalah basa karena menerima ion H+ (proton akseptor) dari
molekul H3O+.
H2O dan
H3O+ adalah pasangan asam-basa konjugasi,
dimana H2O adalah basa konjugasi dari H3O+, begitupun sebaliknya H3O+ adalah asam konjugasi dari H2O.
Begitupun hal nya
dengan OH ̶ dan H2O
merupakan pasangan asam-basa
konjugasi, dimana OH ̶ adalah basa konjugasi dari H2O,
juga sebaliknya H2O adalah asam konjugasi dari OH ̶ .
Kesimpulan
Contoh 2 :
Molekul HCl adalah asam karena mendonorkan ion H+ nya untuk molekul H2O membentuk H3O+, dan molekul H2O adalah basa karena menerima ion H+ (akseptor proton). Begitu juga sebaliknya ion H3O+ adalah asam karena mendonorkan ion H+ nya untuk ion Cl ̶ membentuk molekul HCl, sedangkan ion Cl ̶ adalah basa karena menerima ion H+ (akseptor proton).
3.
Teori
Asam Basa Lewis
Pada tahun 1932, ahli Kimia G.N.
Lewis mengajukan konsep baru mengenai asam dan basa melengkapi kekurangan dari
konsep atau teori sebelumnya, yang dikenal dengan asam Lewis dan basa Lewis.
Berdasarkan konsep tersebut Asam
Lewis adalah suatu senyawa yang
mampu menerima pasangan elektron dari senyawa lain, atau akseptor pasangan
elektron, sedangkan Basa Lewis adalah suatu senyawa yang mampu memberikan pasangan
elektron dari senyawa lain, atau donor pasangan elektron. Konsep ini
mengembangkan konsep dari Bronsted-Lowry yang lebih luas.
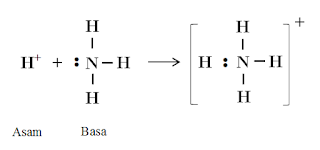
Contoh :
Penjelasannya:
Pada Gambar 3 ditunjukkan bahwa ion
H+ merupakan asam Lewis, karena menerima pasangan
elektron, sedangkan NH3 adalah basa Lewis karena mendonorkan
sepasang elektronnya.
Dalam dunia kedokteran dan farmasi
dikenal adanya senyawa basa Lewis yang digunakan sebagai obat keracunan logam
berat, misalnyamerkuri, timbal, kadmium dan logam lain sejenisnya.Obat tersebut
dikelompokkan sebagai British Anti Lewis Acid (BAL). Kandungan obat tersebut
antara lain adalah senyawa oksalat dan etilendiamintetraasetat
(EDTA).Peranan BAL dalam obat tersebut adalah mengikat logam berat agar tidak
menggangu kerja enzim.
Contoh :
Hg2+(aq)
+ 2C2O4
̶ (aq) → [Hg(C2O4)2] ̶ (aq)
Asam Basa
Cd2+(aq)
+ 2(EDTA) 4 ̶ (aq) → [Cd(EDTA)2]
6 ̶ (aq)
Asam Basa
C.
KESETIMBANGAN
ION DALAM LARUTAN ASAM – BASA (Next...)
D.
DERAJAT
KEASAMAN (Next...)
E.
REAKSI
ASAM DENGAN BASA (Next...)



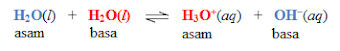


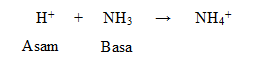





Tidak ada komentar:
Posting Komentar