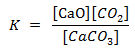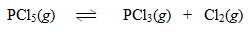KESETIMBANGAN KIMIA
PETA KONSEP
A.
REAKSI BOLAK-BALIK DAN KESETIMBANGAN KIMIA
1.
Reaksi
Bolak-balik dan Kesetimbangan Dinamis
Dalam reaksi kimia, kesetimbangan
kimia adalah keadaan saat kedua reaktan dan produk hadir
dalam konsentrasi yang tidak memiliki kecenderungan lebih lanjut
untuk berubah seiring berjalannya waktu. Biasanya, keadaan ini terjadi ketika
reaksi ke depan berlangsung pada laju yang sama dengan reaksi balik. Laju pada
reaksi maju dan mundur umumnya tidak nol, tapi sama. Dengan demikian, tidak ada
perubahan bersih dalam konsentrasi reaktan dan produk. Keadaan seperti ini
dikenal sebagai kesetimbangan dinamis.
Contoh :
NaOH(aq) + HCl(aq) →
NaCl(aq) + H2O(l)
Reaksi
tersebut adalah reaksi satu arah, hanya berlangsung ke arah kanan. Hal ini
menunjukkan bahwa bila NaCl direaksikan kembali dengan H2O tidak
akan terjadi reaksi.
Sedangkan
reaksi
menunjukkan bahwa reaksi dapat berlangsung
dalam dua arah. Senyawa NH3 yang tebentuk dapat terurai kembali
menjadi gas N2 dan H2. Hal inilah yang disebut sebagai reaksi
dapat balik (reaksi bolak-balik) atau reaksi reversible.
Sedangkan reaksi yang hanya berlangsung satu arah disebut reaksi irreversible.
2. Reaksi
Kesetimbangan
Kesetimbangan
kimia dapat digolongkan kedalam dua bagian:
a.
Kesetimbangan Homogen
Kesetimbangan
homogen terjadi jika fase reaktan dan produk yang terlibat dalam reaksi
wujudnya sama, yaitu gas (g) seluruhnya atau larutan (aq) seluruhnya.
Contoh:
b.
Kesetimbangan Heterogen
Kesetimbangan heterogen terjadi jika fase reaktan dan produk yang terlibat dalam reaksi wujudnya berbeda.
Contoh:
Contoh
soal
Dalam suatu wadah direaksikan
larutan yang mengandung 0,01 mol Fe3+ dengan larutan yang mengandung
0,01 mol ion SCN ̶ hingga terjadi reaksi kesetimbangan berikut:
Dalam keadaan
setimbang ternyata terdapat ion Fe3+ sebanyak 0,004 mol. Hitunglah
berapa mol ion SCN ̶ dan FeSCN2+
yang terdapat dalam sistem.
Jawab:
diketahui:
Mol
Fe3+ yang terurai = 0.01 mol -
0,004 mol
=
0,006 mol
Mol
SCN ̶ yang
terurai = perbandingan koefisien Fe3+ : SCN ̶
= 1 : 1
maka
jumlah molnya = 1 / 1
. 0,006 mol
=
0,006 mol
FeSCN2+
yang terbentuk = 1 / 1 x
0,006 mol
= 0,006 mol
Jumlah mol SCN ̶ = 0,01 mol - 0,06 mol
= 0,004 mol
Jumlah mol FeSCN2+ =
0,006 mol
B. HUKUM KESETIMBANGAN DAN TETAPAN KESETIMBANGAN
Pada keadaan
reaksi dalam kesetimbangan, konsentrasi zat-zat yang ada selalu tetap karena
pada saat yang sama jumlah zat yang bereaksi sama dengan jumlah zat yang
dihasilkan. Contoh pada reaksi kesetimbangan :
Dari data hasil pengukuran persamaan reaksi kesetimbangan tersebut didapatkan hasil reaksi pada persamaan reaksi yang pertama diperoleh nilai tetap pada hasil perhitungan dengan rumus:
Sedangkan pada percobaan kedua, diperoleh
nilai tetap pada hasil perhitungan dengan rumus:
Berdasarkan data percobaan tersebut, maka untuk reaksi kesetimbangan
didapatkan nilai tetap dengan rumus:
Persamaan ini
merupakan hukum aksi massa atau hukum kesetimbangan (K), yang
menyatakan bahwa dalam keadaan setimbang,
hasil kali konsentrasi zat-zat hasil reaksi yang dipangkatkan koefisiennya
dibagi dengan hasil kali konsentrasi zat-zat pereaksi yang dipangkatkan koefisiennya
akan mempunyai nilai yang tetap.
Contoh :
Nilai yang
diperoleh dari perhitungan hukum kesetimbangan disebut dengan tetapan
kesetimbangan. Tetapan kesetimbangan adalah khas untuk suatu reaksi dan
nilainya tetap pada suhu tertentu. Artinya setiap reaksi memiliki nilai tetapan
kesetimbangan tertentu pada kondisi tertentu.
Untuk reaksi
kesetimbangan heterogen, dimana zat-zat yang terlibat dalam reaksi mempunyai
wujud (fase) yang berbeda, cara
menyatakan tetapan kesetimbangan (K)
dapat disederhanakan. Contohnya pada reaksi peruraian kalsium karbonat padat
(batu kapur) menjadi kalsium oksida dan gas karbon dioksida, yang terdapat pada
proses pembuatan kapur tohor (gamping) dari kapur yang berlangsung pada suhu
tinggi. Reaksi kesetimbangannya adalah:
Hukum kesetimbangannya dinyatakan
dengan :
Zat padat
seperti CaCO3 dan CaO mempunyai konsentrasi tetap, sehingga nilai tetapan
kesetimbangan (K) pada reaksi
tersebut adalah:
karena nilai [CaCO3] dan
[CaO] tetap, maka tetapan kesetimbangan reaksi :
K = [CO2]
Pada kesetimbangan heterogen, zat yang memengaruhi tetapan kesetimbangan konsentrasi hanya yang berwujud gas (g) dan larutan (aq).
Contoh :
Latihan
soal
1.
Tuliskan rumus hukum kesetimbangan (K)
untuk reaksi berikut
2. Pada ToC di dalam ruangan 10 liter terdapat kesetimbangan 0,2 mol PCl5; 0,3 mol PCl3; dan 0,1 mol Cl2 menurut reaksi setimbang:
Tentukan nilai tetapan kesetimbangan bagi reaksi tersebut.
1. Nilai Tetapan Kestimbangan dan Tekanan Gas
Untuk reaksi
yang melibatkan gas, tetapan kesetimbangannya dapat dinyatakan dari nilai
tekanan parsial masing-masing gas pada saat setimbang, sebab konsentrasi gas
dalam suatu ruangan akan menentukan besarnya tekanan gas tersebut dalam
ruangan. Untuk membedakan nilai tetapan kesetimbangan yang diperoleh dari nilai
konsentrasi dan dari nilai tekanan parsial, maka untuk selanjutnya nilai tetapan kesetimbangan yang diperoleh berdasarkan
konsentrasi diberi lambang Kc sedangkan untuk nilai
tetapan kesetimbangan yang diperoleh berdasarkan tekanan parsial diberi lambang Kp.
Untuk reaksi setimbang:
dengan
: PA = Tekanan parsial gas A
PB = Tekanan parsial gas B
PC
= Tekanan
parsial gas C
PD
= Tekanan
parsial gas D
PA + PB + PC + PD
= P total ruangan
Berdasarkan
hukum tentang gas idel, P.V
= n.R.T, dapat dicari
hubungan antara Kc dengan Kp
P.V
= n.R.T
maka, PA
= [A]
RT
PB = [B] RT
PC
= [C]
RT
PD
= [D]
RT
sehingga
2. Kesetimbangan
Disosiasi dan Derajat Dsisosiasi
Reaksi disosiasi adalah reaksi peruraian zat menjadi zat yang lebih sederhana.Apabila reaksinya merupakan reaksi kesetimbangan, maka reaksinya disebut reaksi kesetimbangan. Didalam sistem kesetimbangan disosiasi dikenal dengan adanya derajat disosiasi (α) yang menyatakan banyaknya bagian zat yang terurai, dan dinyatakan dengan:
Derajat
disosiasi mempunyai nilai antara 0 sampai dengan 1, atau antara 0% sampai 100%.
Jika nilai α = 0 atau 0% berarti tidak ada zat yang terurai, dan jika α = 1
berarti zat terurai sempurna atau semua zat mengalami disosiasi.
Contoh:
Dalam ruang satu liter dipanaskan
gas HI hingga terurai membentuk reaksi kesetimbangan:
Pada suhu
tertentu nilai tetapan kesetimbangannya (Kc) adalah 4. tentukan:
a. persentase
HI yang terurai
b. komposisi
masing-masing gas pada saat setimbang
Jawab:
a. persentase HI
b. Komposisi
pada saat setimbang
Jumlah mol HI, H2 dan I2 adalah sebagai berikut :
C.
PERGESERAN KESETIMBANGAN
Suatu sistem
dalam keadaan setimbang cenderung akan mempertahankan kesetimbangannya, sehingga
jika ada pengaruh dari luar maka sistem tersebut akan berubah sedemikian rupa
agar segera diperoleh keadaan kesetimbangan lagi. Kondisi seperti ini dikenal
dengan asas Le Chatelier, yaitu jika
dalam suatu sistem kesetimbangan diberikan aksi, maka sistem akan berubah
sedemikian rupa sehingga pengaruh aksi itu sekecil mungkin. Beberapa aksi
yang dapat menimbulkan perubahan pada sistem kesetimbangan antara lain adalah
perubahan konsentrasi, perubahan volume, perubahan tekanan dan perubahan suhu.
1.
Pengaruh Perubahan Konsentrasi
Jika
salah satu komponen (zat) yang terdapat dalam sistem konsentrasinya diperbesar,
maka kesetimbangan akan bergeser ke arah menjauh dari komponen (zat)
yang konsentrasinya diperbesar. Sebaliknya jika salah satu komponen
(zat) yang terdapat dalam sistem konsentrasinya dikurangi, maka
kesetimbangan akan bergeser ke arah mendekati komponen (zat) yang konsentrasinya dikurangi.
Ilustrasinya bisa pada sistem
kesetimbangan berikut :
mempunyai tetapan kesetimbangan (dinayatakan dalam K1)
Misalnya dilakukan penambahan pada
konsentrasi Fe3+ sehingga konsentrasinya bertambah menjadi dua kali dari
semula, maka didapatkanlah nilai K (dinyatakan dalam K2)
maka nilai K1 > K2.
Oleh karena nilai K1 harus
sama dengan nilai K2, maka
kesetimbangan akan berusaha menurunkan konsentrasi ion Fe3+ dan ion
SCN ̶ serta menambah konsentrasi FeSCN2+. Akibatnya kesetimbangan
akan bergeser ke kanan (menjauhi zat
yang konsentrasinya ditambah). Sebaliknya apabila dilakukan pengurangan
pada konsentrasi Fe3+ sehingga konsentrasinya berkurang menjadi
setengah kali dari semula, maka didapatkanlah nilai K (dinayatakan dalam K3)
Oleh karena suhunya tetap, maka
nilai K1 harus sama dengan
nilai K3. Akibatnya,
kesetimbangan akan melakukan reaksi dengan mengurangi konsentrasi FeSCN2+
serta menambah konsentrasi ion Fe3+ dan ion SCN ̶.
Sehingga kesetimbangan akan bergeser ke kiri (mendekati zat yang konsentrasinya dikurangi).
2.
Perubahan Volume
Menurut
azas Le Chatelier, bila volume
sistem kesetimbangan diperbesar, maka kesetimbangan akan bergeser ke
arah ruas yang mempunyai jumlah molekul (koefisien) yang besar.
Sebaliknya bila volume sistem kesetimbangan diperkecil, maka kesetimbangan
akan bergeser ke arah ruas yang mempunyai jumlah molekul (koefisien) yang kecil.
Mari
kita melihat kesetimbangan pada reaksi berikut:
Nilai tetapan kesetimbangan reaksi
tersebut adalah K1.
Setelah volume diperbesar menjadi
dua kali dari semula maka terjadi perubahan konsentrasi sebagai berikut:
Nilai tetapan kesetimbangan reaksi
tersebut setelah mengalami perubahan adalah K2.
Kesetimbangan tidak mengalami pergeseran
karena jumlah molekul di ruas kiri sama dengan jumlah molekul diruas kanan.
Berbeda halnya jika pada
kesetimbangan reaksi berikut:
Bila di dalam sistem volumenya diperbesar, maka kesetimbangan akan bergeser ke arah ruas kiri, karena
jumlah molekul di ruas kiri lebih besar. Begitu pula sebaliknya, jika di dalam sistem volumenya diperkecil maka kestimbangan akan bergeser ke arah kanan, karena di ruas
kanan jumlah molekulnya lebih kecil.
3.
Perubahan Tekanan
Perubahan tekanan akan bepengaruh pada konsentrasi gas-gas dalam kesetimbangan. Untuk mengetahui bagaimana pengaruh perubahan tekanan terhadap sistem kesetimbangan gas, kita merujuk kembali pada persamaan gas ideal.
Dari
persamaan tersebut dapat diambil kesimpulan bahwa perubahan tekanan berbanding
terbalik dengan perubahan volume. Sehingga apabila tekanan pada sistem diperbesar
maka kesetimbangan
akan bergeser ke arah ruas yang memiliki jumlah molekulnya lebih kecil.
Sebaliknya bila tekanan diperkecil, maka kesetimbangan akan bergeser ke arah ruas
yang memiliki jumlah molekulnya lebih besar.
4. Perubahan Suhu
Perubahan suhu pada reaksi kesetimbangan akan menyebabkan terjadinya perubahan nilai tetapan kesetimbangan (K). Untuk mengetahui bagaimana perubahan suhu terhadap pergeseran kesetimbangan, berikut disajikan data nilai K untuk berbagai suhu dari dua reaksi kesetimbangan yang berbeda.
Perbedaan
dari kedua reaksi tersebut adalah nilai perubahan entalpinya. Untuk reaksi
pembentukan NH3, perubahan eltalpinya negatif (reaksi eksoterm) yang
menunjukkan bahwa reaksi ke kanan melepaskan kalor. Sedangkan pada reaksi antara
gas H2 dan CO2, perubahan entalpinya positif (endoterm)
yang menunjukkan bahwa reaksi ke kanan menyerap kalor. Jika sistem dalam
kesetimbangan suhunya dinaikkan maka kesetimbangan akan bergeser ke arah reaksi
endoterm atau ∆H positif. Dan sebaliknya, jika dalam sistem
kesetimbangan suhunya diturunkan maka kesetimbangan akan bergeser ke arah reaksi
eksoterm atau ∆H negatif.
5.
Pengaruh Katalis pada Reaksi
Setimbang
Reaksi pembuatan amonia berlangsung sebagai berikut:
Katalis
akan mempercepat laju reaksi pembentukan NH3 sekaligus juga akan mempercepat
reaksi peruraian NH3 menjadi gas H2 dan N2. Pengaruh ini
sama kuatnya sehingga di dalam reaksi kesetimbangan katalis tidak menggeser
kesetimbangan, tetapi hanya mempercepat lajunya reaksi untuk mencapai
kesetimbangan.
D.
KESETIMBANGAN KIMIA DALAM INDUSTRI
Proses Industri
pada bagian ini yang akan membahas tentang produksi amonia (NH3) dan
asam sulfat (H2SO4).
1. Proses Haber-Bosch pada Pembuatan Amonia
Amonia
(NH3) merupakan senyawa penting dalam bidang kimia produksi. Sebagai
contoh dalam pembuatan pupuk, asam nitrat dan senyawa nitrat untuk berbagai
keperluan.Proses pembuatan amonia dilakukan melalui reaksi:
Proses
ini dikenalkan oleh Fritz Haber ilmuwan berkebangsaan Jerman. Proses reaksi
pembuatan amonia ini terkenal dengan proses Haber-Bosch untuk
menghormati Karl Bosch, seorang insinyur yang mengembangkan peralatan
pembuatan amonia untuk skala industri.
Reaksi
pembuatan amonia ni merupakan reaksi kesetimbangan.Oleh karena itu untuk
mendapatkan amonia sebanyak-banyaknya digunakan azas Le Chatelier pada prosesnya. Untuk menggeser kesetimbangan ke arah pembentukan NH3, maka konsentrasi N2 dan H2
diperbesar, dengan cara menaikkan tekanan kedua gas tersebut). Faktor lainnya
yang harus diperhatikan adalah suhu dan tekan reaksi.
Reaksi
yang terjadi pada proses pembuatan amonia ini adalah reaksi eksoterm, oleh
sebab itu suhu reaksi harus diperkecil atau suhu reaksi harus rendah. Jika suhu
rendah maka reaksi antara N2 dan H2 menjadi lambat, oleh
karena itu harus ditambahkan katalis Fe yang diberi promotor (bahan yang
mengaktifkan kerja katalis) Al2O3 dan K2O.
Tekanan reaksipun harus diperhatikan, NH3 akan banyak tebentuk pada
kondisi reaksi dengan tekanan yang tinggi. Faktor pendudukung yang menyertainya
adalah biaya yang lebih besar dan keamanan konstruksi bangunan pabrik.
2.
Pembuatan Asam Sulfat dengan proses
Kontak
Asam
sulfat juga merupakan bahan industri kimia lainnya yang sangat penting, yaitu
digunakan sebagai bahan baku pembuatan pupuk. Proses pembuatan asam sulfat (H2SO4)
ada dua cara, yaitu dengan proses kamar timbal dan proses kontak. Proses kamar
timbal sudah ditinggalkan karena kurang menguntungkan secara ekonomi. Sedangkan
proses kontak menghasilkan asam sulfat dengan kadar mencapai 99% dan biaya yang dikeluarkan lebih murah. Di
Indonesia pabrik asam sulfat antara lain terdapat di Petrokimia Gresik, PT
Pusri Palembang, dan Kujang Jawa Barat.
Pembuatan asam sulfat meliputi tiga
tahap yaitu:
a) Pembakaran belerang menjadi belerang
dioksida
S(s)
+ O2(g)
→
SO2(g)
b) Oksidasi SO2 menjadi SO3
c) Mereaksikan SO3 dengan air. Pada tahap ini SO3 tidak langsung direaksikan air, tetapi dilarutkan terlebih dahulu ke dalam larutan H2SO4
Belerang
dioksida yang dihasilkan harus benar-benar murni, sebab jika mengandung
pengotor akan mengganggu proses selanjutnya. Di Petrokimia Gresik, gas SO2
di peroleh dari sisa pengolahan tembaga atas kerjasama dengan PT Freeport
Indonesia (Papua).
Tahapan yang
paling menentukan pada proses pembuatan asam sulfat adalah tahapan kedua, yaitu
proses perubahan SO2 menjadi SO3. Reaksi pada proses ini
merupakan reaksi kesetimbangan, maka untuk memperbanyak hasil harus
memperhatikan azas Le-Chatelier.
a. Reaksi tersebut menyangkut tiga partikel
pereaksi (dua partikel SO2 dan satu partikel O2) untuk
menghasilkan dua partikel SO3. Jadi perlu dilakukan pada tekanan
yang tinggi.
b. Reaksi ke kanan adalah reaksi eksoterm (∆H
= ̶ 196 kJ), berarti harus dilakukan pada suhu
rendah. Masalahnya bila dilakukan suhu rendah, reaksi akan berlangsung lambat.
Oleh sebab itu harus ditambahkan sebuah katalis, yaitu V2O5.