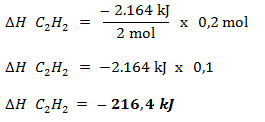Belajar dengan tekun dan beradab agar dapat mengajarkannya dengan baik dan sempurna
Selasa, 29 September 2020
SENYAWA KARBON - GUGUS FUNGSI
Senin, 28 September 2020
KIMIA UNSUR @PPT SISWA
Senin, 21 September 2020
LATIHAN SOAL TERMOKIMIA
1. Reaksi berikut merupakan reaksi dengan perubahan entalpi pembentukan standar (∆Hfo) CaCO3 adalah...
a. 2Ca(s) + C(s) + O2(g) → 2CaCO3(s)
b. Ca(s) + C(s) + 3/2O2(g) → CaCO3(s)
c. CaO(s) + CO2(g) → CaCO3(s)
d. Ca(OH)2(aq) + CO2(g) → CaCO3(s) + H2O(l)
e. CaCl2(aq) + Na2CO3(aq) → CaCO3(s) + 2NaCl(aq)
Jawabannya
: B
Pembahasannya:
Reaksi pembentukan standar adalah pembentukan 1 mol CaCO3 yang dibuat dari unsur-unsur yang paling stabil, yaitu Ca, C dan O2 .
2.
Pada peruraian 3,2 gram gas CH4
(Ar C= 12; Ar H = 1) dibutuhkan kalor sebesar 14,96 kJ, maka ∆Hfo CH4
adalah...
a. ̶ 149,6 kJ/mol
b. ̶ 74,8 kJ/mol
c. ̶ 29,92 kJ/mol
d. +
29,92 kJ/mol
e. + 74,8 kJ/mol
Jawabannya : E
Pembahansannya :
Reaksi
peruaraian CH4 adalah :
CH4(g)
→ C(s)
+ H2(g) ∆H = + 74,8 kJ/mol
Catatan :
∆H = + (positif), karena membutuhkan kalor dan termasuk reaksi endoterm.
3.
Jika pada 50 mL larutan tembaga (II)
sulfat 0,4 M ditambahkan serbuk seng (sedikit berlebihan), suhu larutan akan
naik 20 oC. Dengan menganggap kalor jenis larutan 4,18 J/gram oK
dan kapasitas kalor wadah diabaikan, maka ∆H
untuk reaksi :
Cu2+(aq) + Zn(s) → Cu(s)
+ Zn2+(aq)
adalah...
a. ̶ 209
kJ/mol
b. ̶ 83,6
kJ/mol
c. +
83,6 kJ/mol
d. +
209 kJ/mol
e. +
836 kJ/mol
Jawabannya
: A
Pembahasannya :
Diketahui :
mlarutan = 50 mL
clarutan = 4,18 J/gram oK
∆T = 20 oC = 20 oK
Rumus :
qsistem = m . c . ∆T
qsistem = 50
gram x 4,18 J/gram oK x 20 oK
qsistem = 4.180 Joule = 4,18 kJ
Kalor pada setiap 1 molnya adalah :
Persamaan
reaksinya menjadi :
Cu2+(aq) + Zn(s) → Cu(s) + Zn2+(aq) ∆H = ̶ 209 kJ/mol
Catatan:
∆H = ̶ (negatif), karena suhu pada sistem meningkat, artinya sistem melepaskan panas/kalor dan termasuk reaksi eksoterm.
4.
Perhatikan persamaan reaksi berikut :
2NaHCO3(aq) → Na2CO3(g)
+ H2O(l)
+ CO2(g)
Diketahui
∆Hfo
NaHCO3(g) = 95
kJ/mol, ∆Hfo Na2CO3(g) = 120
kJ/mol, ∆Hfo H2O(g) = 80 kJ/mol dan ∆Hfo CO2(g) = 75
kJ/mol.
Perubahan
entalpi reaksi adalah...
a.
̶
3.707 kJ
b.
̶
863 kJ
c.
̶
85 kJ
d. +
85 kJ
e. +
863 kJ
Jawabannya : D
Pembahsannya :
∆Hr = ∑ ∆Hf sesudah reaksi - ∑ ∆Hf sebelum reaksi
∆Hr = ∑ ∆Hfo
ruas
kanan ̶ ∑ ∆Hfo
ruas
kiri
= ( ∆Hfo
Na2CO3 + ∆Hfo H2O + ∆Hfo CO2
) ̶ (2 . ∆Hfo
NaHCO3 )
= (120 +
80 + 75) ̶ (2
x 95)
= (275 ̶
190) kJ
= + 85 kJ
5.
Diketahui :
2Ca(s) + O2(g) → 2CaO(s)
∆H = + 1.271 kJ
C(s) + O2(g) → CO2(g) ∆H = + 394
kJ
CaO(s) + CO2(g) → CaCO3(s) ∆H = + 178
kJ
Perubahan entalpi reaksi
2Ca(s) + 2C(s) + 3O2(g) → 2CaCO3(s)
adalah...
a. ̶ 1.207 kJ
b. ̶ 1.843 kJ
c. ̶ 2.021 kJ
d. ̶ 2.237 kJ
e. ̶ 2.415 kJ
Jawabannya
: E
Pembahsannya :
Persamaan reaksinya (Hukum Hess)
2CaCO3(s) → 2Ca(s) + 2C(s) + 3O2(g)
Persamaamnya
2CaCO3(s) → 2Ca(s) + 2C(s) + 3O2(g) ∆H = ̶ 2.415 kJ
Catatan :
Hasil penjumlahan reaksi harus sesuai (sama) dengan reaksi awalnya.
6.
Diketahui :
∆Hfo
H2O(g) = ̶ 242 kJ/mol
∆Hfo
CO2(g) = ̶ 394 kJ/mol
∆Hfo
C2H2(g) = + 52 kJ/mol
Jika 5,2 gram C2H2
dibakar secara sempurna sesuai dengan persamaan reaksi
2C2H2 + 5O2(g)
→ 4CO2(g)
+ 2H2O(g)
akan dihasilkan kalor sebesar... (Ar C = 12; Ar H =
1)
a. 391
kJ/mol
b. 432
kJ/mol
c. 1.082
kJ/mol
d. 2.164
kJ/mol
e. 4.328
kJ/mol
Jawabannya
: A
Pembahasannya :
Rumus
∆Hr = ∑ ∆Hf sesudah reaksi - ∑ ∆Hf sebelum reaksi
= ( 4 .
∆Hfo
CO2 + 2 . ∆Hfo H2O
) ̶ ( 2 .
∆Hfo C2H2
+
5 . ∆Hfo O2 )
=
( 4 . ̶ 394 + 2 . ̶ 242 ) ̶ ( 2 . 52 + 5 . 0 )
=
(
̶ 1.576
̶
484) ̶ 104
=
̶ 2.164
kJ
Persamaan reaksi
2C2H2 + 5O2(g) → 4CO2(g) + 2H2O(g) ∆H = ̶ 2.164 kJ
Menentukan jumlah mol C2H2
maka
energi yang dilepaskan dalam pembakaran C2H2 0,2 mol adalah :
7. Diketahui energi ikatan rata-rata :
C = C = 839 kJ/mol
C ̶ C =
343 kJ/mol
H ̶ H = 436
kJ/mol
C ̶ H = 410
kJ/mol
Perubahan entalpi yang terjadi pada
reaksi
CH3 ̶ CH = CH2 + H2 → CH3 ̶ CH2 ̶ CH3
adalah sebesar...
a. +
548 kJ/mol
b. +
271 kJ/mol
c. +
112 kJ/mol
d. ̶ 112
kJ/mol
e. ̶ 548
kJ/mol
Jawabannya
: C
Pembahasannya :
Persamaan reaksi dalam bentuk bangun :
Perubahan
entalpinya adalah
Ikatan yang
putus : 6 ikatan C – H : 6 x 410
kJ =
2.460 kJ
(ruas kiri) 1
ikatan C – C :
1 x 343 kJ = 343
kJ
1 ikatan C = C : 1 x 839 kJ = 839
kJ
1 ikatan H – H : 1 x 436 kJ = 436
kJ
Ikatan yang
terbentuk : 8 ikatan C – H : 8 x 410 kJ
= 3.280 kJ
(ruas kanan) 2 ikatan C – C :
2 x 343 kJ = 686
kJ
Rumus :
∆Hikatan
= ∑ Energi ikatan zat pereaksi - ∑ Energi ikatan zat
hasil reaksi
= ( ∑ ∆Hpemutusan ikatan - ∑ ∆Hpenggabungan ikatan )
= ( ∑ ∆H ruas kiri – ∑ ∆H ruas kanan )
= (6 . ∆HC-H + ∆HC-C + ∆HC=C + ∆HH-H) – (8
. ∆HC-H
+ 2 . ∆HC-C)
= (0
+ 0 +
839 + 436) – (2
. 410 + 343)
= (839
+ 436) – (820
+ 343)
= 1275 – 1163
= + 112 kJ
Untuk memudahkan perhitungan ruas kiri dan ruas kanan yang jenisnya sama langsung dikurangkan.
8. Pernyataan yang benar tentang reaksi
endoterm adalah...
a. Entalpi
awal lebih besar dari entalpi akhir dan ∆H > 0
b. Entalpi
awal lebih kecil dari entalpi akhir dan ∆H > 0
c. Entalpi
awal lebih besar dari entalpi akhir dan ∆H < 0
d. Entalpi
awal lebih kecil dari entalpi akhir dan ∆H < 0
e. Entalpi
awal sama dengan entalpi akhir dan ∆H = 0
9.
Perhatikan diagram energi berikut
a. ∆H2 = ∆H3 + ∆H1
b. ∆H3 = ∆H1 + ∆H2
c. ∆H1 = ∆H3 + ∆H2
d. ∆H2 = 2∆H3
̶
∆H1
e. ∆H2 = ∆H3 ̶ 2∆H1
10. Diketahui siklus Hess sebagai berikut :
Nilai ∆Hf o metanol (CH3OH) adalah...
a. ̶ 1.605
kJ
b. ̶ 345
kJ
c. + 345 kJ
d. +
1.605 kJ
e. +
3.225 kJ
POSTING BEFORE
-
1. SENYAWA TURUNAN ALKANA PETA KONSEP Gugus Fungsi merupakan turunan Senyawa Karbon Alkana (di- KLIK ) terbagi menjadi : A. ALKOHOL (K...
-
SOAL SOAL TATA NAMA ALKANA Jawablah pertanyaan di bawah ini dengan tepat ! 1. Amatilah rantai karbon berikut ini : Nama y...
-
A. REAKSI ALKANA Reaksi pada alkana umumnya merupakan reaksi substitusi , yaitu reaksi penggantian gugus atom hidrogen pada suat...